- 细胞发育与未来农业前沿论坛第四十六期成功举办 2025-04-14
- 北京师范大学任海云教授做客细胞发育与未来农业前沿论坛第二十七期 2023-11-24
- 德国马普植物生理所Reimo Zoschke博士做客细胞发育与未来农业前沿论坛第二十... 2023-11-23
- 清华大学刘玉乐教授做客细胞发育与未来农业前沿论坛第二十五期 2023-11-15
- 瑞士日内瓦大学教授Jean-David Rochaix做客植物细胞与发育前言论坛第二十三... 2023-09-24
- 中国科学院遗传与发育生物学研究高彩霞研究员做客植物细胞与发育前沿论坛第... 2023-09-04
- 韩国建国大学尹大珍(Dae-Jin Yun)教授做客细胞发育与未来农业前沿论坛第二... 2023-07-19
- 中国科学院遗传与发育生物学研究所谢旗研究员做客细胞发育与未来农业前沿论... 2023-06-06
- 奥地利科学技术研究院Daniel Zilberman教授做客细胞发育与未来农业前沿论坛... 2023-06-01
- 中国科学技术大学谭树堂教授做客细胞发育与未来农业前沿论坛第十七期 2023-05-28
- 山东农业大学卢从明教授做客细胞发育与未来农业前沿论坛第十六期 2023-05-22
- 荷兰拉德堡德大学须健教授做客细胞发育与未来农业前沿论坛第十五期 2023-05-18
- 中国科学院分子植物科学卓越创新中心刘宏涛研究员做客植物细胞与发育前沿论... 2023-04-04
- Nat Commun-方玉达/涂晓雨团队合作揭示组蛋白H2A通过cohesin靶向进行单泛素... 2023-03-06
- PNAS—薛红卫课题组与合作者揭示磷脂酸细胞器间转运进而调控叶绿体发育的机... 2023-02-02
-
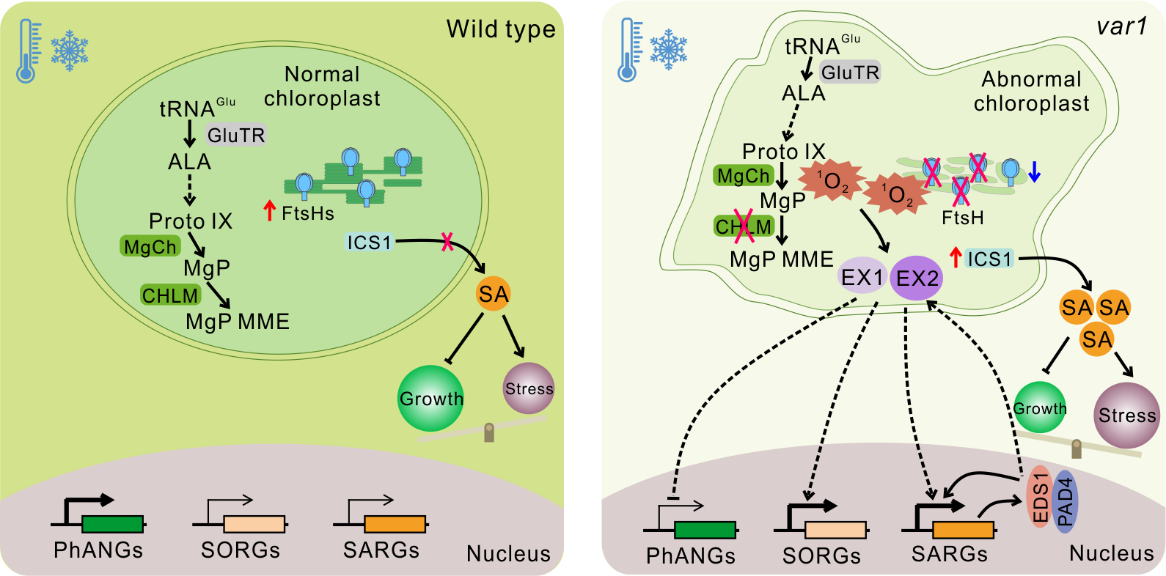
2025年5月7日,中心武国章课题组在国际知名植物学期刊Plant Communications(IF: 9.4)上发表了题为“Chloroplast ATP-dependent metalloprotease FtsH5/VAR1 confers cold stress tolerance through singlet oxygen and salicylic acid signaling”的研究论文,揭示了叶绿体FtsH5/VAR1蛋白酶通过调控低温下叶绿体的生物发生,维持单线态氧和水杨酸稳态,从而影响植物低温耐受性的机制,并发现单线态氧信号途径EX2蛋白在该过程中的关键作用,为深入理解植物低温耐受的分子机制和耐低温作物分子育种提供了重要依据。

温度是影响植物生长和地理分布的重要环境因子之一,低温胁迫会导致植物光合作用效率下降、生长迟缓,严重时会造成细胞和植株死亡。叶绿体是植物进行光合作用和多种代谢活动的细胞器,同时也是植物细胞内活性氧(ROS)产生和防御激素水杨酸(SA)合成的重要场所,在植物应对环境胁迫中发挥重要作用。然而,植物如何整合ROS和SA信号以适应胁迫目前仍有许多未知。
此研究聚焦叶绿体中类囊体膜定位的FtsH5/VAR1蛋白酶,通过对var1突变体的观察发现,在低温胁迫下,该突变体表现出强烈的褪绿、花叶和生长迟缓的表型。进一步研究揭示,SA生物合成和信号传导的激活与var1突变体的低温敏感表型紧密相关。通过敲除SA生物合成相关基因(ICS1、EDS1、PAD4)或过表达水杨酸羟化酶基因(NahG)降低SA的积累量可很大程度抑制var1突变体的低温敏感表型。同时,研究证实单线态氧(1O2)感应器蛋白EXECUTOR1(EX1)介导的1O2信号在低温胁迫下作用于EDS1上游,调控SA响应基因的表达。
值得关注的是,此研究发现EX2蛋白可能通过独立于EX1介导的1O2信号途径发挥关键功能。EX2的突变能够显著抑制var1突变体的低温敏感表型,其在激活SA响应基因和抑制光合作用相关核基因(PhANGs)表达方面发挥重要作用,从而参与VAR1介导的植物低温耐受性调控。
该研究阐释了VAR1在植物耐低温性中的重要作用,以及1O2和SA信号之间的紧密联系与互作,从而维持SA稳态对植物低温耐受性的重要性,同时揭示了EX2此前未被关注和深入研究的功能。这些结果为深入理解植物的抗寒机制以及叶绿体在植物耐寒性中的作用提供了新线索,并为未来通过基因工程手段改良作物耐寒性、提高作物在低温环境下的产量奠定了基础。
上海交通大学农业与生物学院博士研究生王寅松为该论文第一作者,武国章副教授为通讯作者�%���������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������
-
2025年4月14日,中心陆钰明团队在植物科学领域知名期刊Plant Communications发表题为“Conditional knockdown of gene expression in plants via 3' UTR editing”的研究论文,成功开发了一种基于内源microRNA(miRNA)的基因条件性敲低平台MiRKD(miRNA-mediated in-locus knockdown)。该技术通过CRISPR-Cas9将特定miRNA靶序列精准插入目标基因的3'非翻译区(3' UTR),实现对基因表达的时空特异性调控,为作物分子育种和基因功能研究提供了全新工具。

基因功能的“开”与“关”是分子生物学研究的核心手段。目前,RNA干扰(RNAi)和CRISPR干扰(CRISPRi)是常用的基因抑制技术,但前者存在脱靶效应和遗传不稳定性,后者依赖外源蛋白的持续表达,难以满足作物育种对精准性和安全性的需求。研究团队另辟蹊径,将目光投向植物内源的miRNA调控网络。miRNA是一类天然存在的小分子RNA,其表达具有高度时空特异性,例如某些miRNA仅在叶片中高表达,或在长日照条件下被激活。陆玉明团队提出:若将miRNA的靶序列插入目标基因的3’ UTR,即可利用miRNA的天然表达特性,构建人工调控回路,实现基因的条件性敲低。
研究团队以水稻为模型,首先通过生物信息学筛选出114个具有组成性、组织特异性或环境响应性表达特征的miRNA。随后,利用CRISPR-Cas9基因编辑技术,将选定的miRNA靶序列精准插入目标基因的3’ UTR。以水稻赤霉素受体基因GID1为例,团队设计了三类实验验证MiRKD的可行性:组成型敲低:插入组成型表达的miR156a靶序列,使水稻赤霉素受体基因GID1表达降低97%,植株呈现显著矮化表型;组织特异性敲低:利用主要在茎中表达的miR396c,使GID1在茎部表达降低30%-50%,而叶片不受影响;环境诱导型敲低:在长日照条件下,光响应miR528可触发GID1表达下降63%,短日照下则无此效应。研究还发现,靶序列在3’ UTR中的插入位置可调节敲低效率。靠近终止密码子的插入(如5-20 bp)能实现94%以上的高效抑制,而远端插入(200-400 bp)的抑制率约为55%,这为基因表达强度的微调提供了新策略。
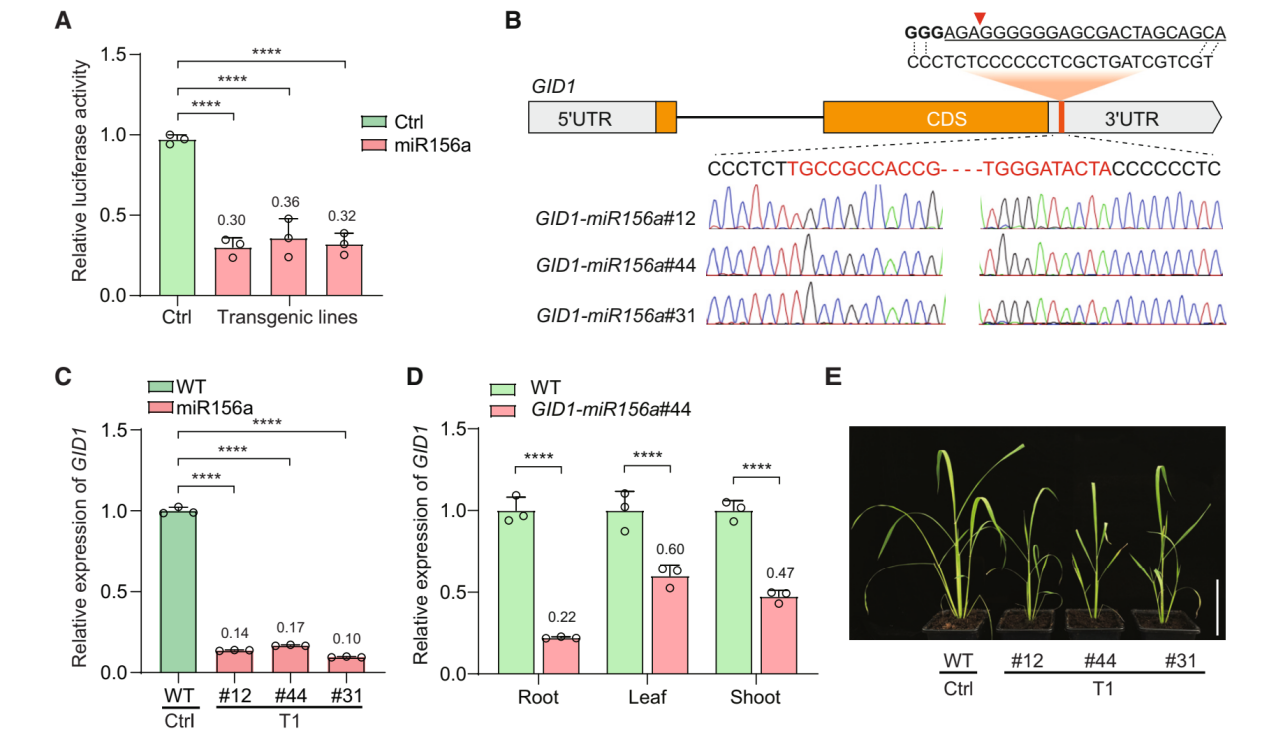
与现有技术相比,MiRKD具有三大核心优势:首先,该方法完全依赖内源性miRNA,无需引入外源蛋白或RNA,避免了转基因生物的安全争议;其次,通过编辑基因自身的3’ UTR,目标蛋白的天然结构得以完整保留,克服了蛋白降解标签技术导致的非天然修饰问题;最后,MiRKD可同时调控多个基因,通过组合不同miRNA的靶序列,未来有望构建复杂的基因表达网络,实现作物性状的模块化设计。研究团队进一步验证了MiRKD的跨物种普适性。在人类细胞系HepG2和HEK293T中,插入肝脏或肾脏特异性miRNA靶序列后,报告基因的表达在相应细胞中特异性下降,表明该技术有望拓展至医学领域,为细胞特异性基因治疗提供新工具。
上海交通大学农业与生物学院博士后刘天珍和沈佳琪为论文并列第一作者,陆钰明教授为通讯作者。博士生钟达庭、博士生王轲麟、硕士生阎嘉蕊、博士后姚琦、博士生叶璐、博士后李凯、硕士生邓琪也参与了本项工作。该研究由国家重点研发计划(2021YFD1201300)、上海市农业技术攻关项目(K2023001)、中国博士后科学基金(2024M751985)等项目资助完成。
论文信息:
Liu T., Shen J., et al. (2025). Conditional knockdown of gene expression in plants via 3' UTR editing. Plant Communications 6, 101291.
DOI: 马铃薯(Solanum tuberosum L.)是一种富含淀粉的重要粮食作物,其茎分为地上茎和匍匐茎,其中地上茎负责直立生长和叶分化,而匍匐茎是形成块茎的特殊器官。因此匍匐茎分生能力的研究对改良马铃薯产量和品质非常重要。近日,中心王旭团队在Plant Cell & Environment杂志发表了题为“Cell Fate Determination of the Potato Shoot Apex and Stolon Tips Revealed by Single-Cell Transcriptome Analysis”的研究论文。该研究对马铃薯匍匐茎茎尖和地上茎茎尖进行了单细胞转录组测序,并开展单细胞水平的比较分析,为马铃薯的分子改良提供了基因资源。

该研究利用单细胞测序对马铃薯的匍匐茎和地上茎进行了单细胞图谱的构建,共获得35,048个高质量的细胞,并可以分为23个细胞簇。根据标记基因的表达模式,这些细胞簇可以分为5种主要的细胞类型,包括表皮细胞、叶肉细胞、维管细胞、增殖细胞和分生细胞。通过对不同细胞类型的比较分析发现,叶肉细胞和表皮细胞是匍匐茎和地上茎的主要差异细胞类型,表现为细胞数量降低和组织特异性高表达基因减少。对激素相关通路基因的表达模式分析发现,生长素和赤霉素在这两种组织中具有显著差异。跨物种分析表明,匍匐茎与拟南芥根尖的相似度高于地上茎,匍匐茎具有更多同源的组织特异性表达基因。此外,对马铃薯和拟南芥的茎尖单细胞数据的整合分析显示,维管组织在物种间相对保守,其中木质部和伴胞的特异性表达基因高度重叠。本研究为马铃薯匍匐茎的发育机制研究提供了丰富的基因资源,有助于加速马铃薯块茎发育相关基础研究的进程。
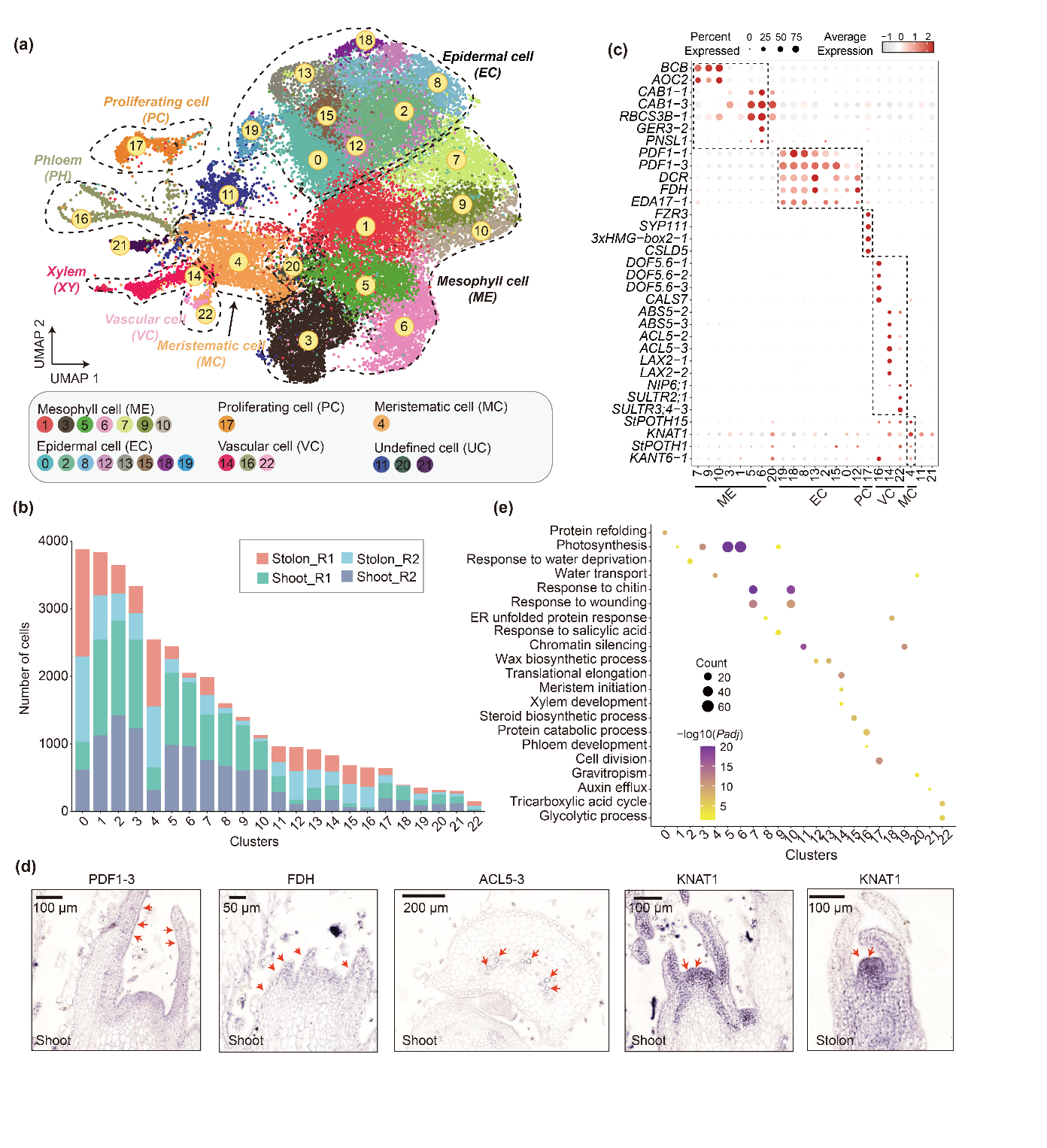
上海交通大学博士研究生郭超程为该论文的第一作者,王旭副教授和王玉东博士后为通讯作者。该研究得到了国家自然科学基金和上海市现代种业协同创新中心项目的资助。
-
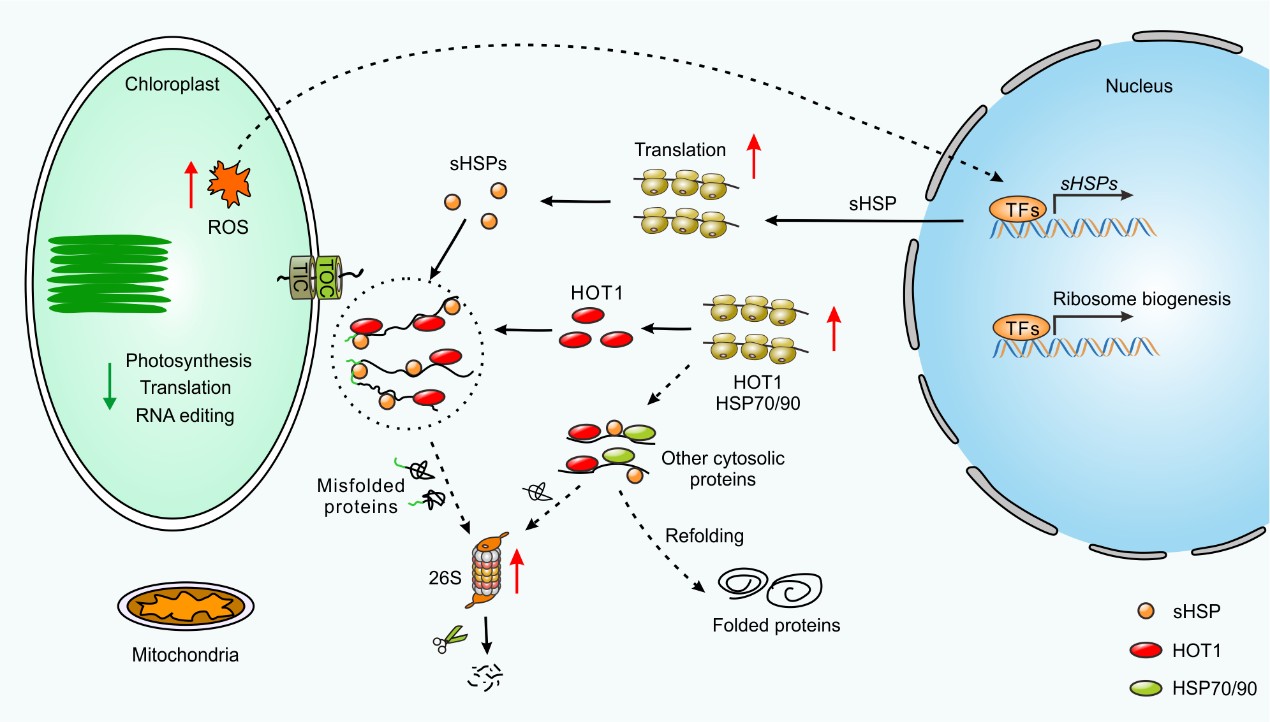
2025年4月22日,中心武国章课题组在国际权威综合性期刊Nature Communications上发表了题为“Chloroplast precursor protein preClpD overaccumulation triggers multilevel reprogramming of gene expression and a heat shock-like response”的研究论文,全面揭示了植物在多层次响应叶绿体前体蛋白积累的细胞学机制,证实蛋白翻译水平调控在激活分子伴侣蛋白(HSP)表达中的重要作用,发现叶绿体活性氧(cpROS)作为叶绿体逆向信号在转录水平激活小分子HSP的表达,证实细胞质分子伴侣ClpB1/HOT1在叶绿体前体蛋白过量积累时维持细胞蛋白稳态中的重要作用,为进一步理解叶绿体蛋白运输调控和逆境下蛋白稳态的维持机制提供了新线索。
俗话说:万物生长靠太阳,植物的叶绿体是接收太阳光能,进行光合作用碳固定的细胞器。作为半自主性细胞器,叶绿体基因组只保留了少量蛋白编码基因,叶绿体内95%以上的蛋白都是在细胞质核糖体上合成前体蛋白,前体蛋白在其N端的叶绿体信号肽引导下进入叶绿体,而后信号肽被剪切掉形成成熟形式的叶绿体蛋白。因此,叶绿体的正常发育和功能发挥均依赖于叶绿体的蛋白内运过程。在高光、高温等逆境条件下,叶绿体的蛋白内运效率下降,会造成叶绿体前体蛋白在细胞质中大量积累,导致细胞质蛋白稳态失衡和胁迫,影响植物生长和作物产量。然而,植物如何响应叶绿体前体蛋白过量积累胁迫(chloroplast precursor overaccumulation stress,cPOS)目前还大部分未知。

本研究通过诱导表达系统和组成型表达系统驱动细胞核编码的叶绿体蛋白ClpD的表达,成功构建了前体蛋白preClpD积累的转基因株系,获得了研究cPOS的良好植物材料。激光共聚焦显微镜观察发现前体蛋白preClpD主要围绕叶绿体外膜成点状聚集体分布,导致叶绿体超微结构受损,造成叶片黄化、光合能力下降、植物生长迟缓等表型。蛋白组学分析以及Western blot验证发现,前体蛋白积累会导致光合作用复合体含量降低,而细胞质核糖体亚基、翻译调控因子、26S蛋白酶体亚基和分子伴侣(HSP)等组分显著积累。Gene Ontology富集分析显示蛋白积累量上升的蛋白富集在“核糖体生物发生”和“蛋白翻译”等过程,多聚核糖体分析进一步证实蛋白翻译水平调控在植物响应前体蛋白过量积累中发挥重要作用。为了探究这些翻译水平调控的具体机制,本研究进行了转录组学和翻译组学联合分析,结合蛋白组学数据,揭示了植物细胞响应前体蛋白过量积累的多层次调控网络。结果显示,当cPOS发生时,叶绿体内的活性氧(cpROS)爆发作为逆向信号在转录水平激活小分子HSP的上调表达。然而,相较于转录水平调控,翻译水平调控在激活HSP表达中发挥更强的作用。为了探究这些HSP在cPOS响应过程中的作用,本研究对翻译水平上调最为显著的HSP100分子伴侣家族成员ClpB1/HOT1蛋白进行功能验证,证实了ClpB1/HOT1在cPOS发生时维持细胞蛋白稳态中的重要作用。
此外,通过分离前体蛋白聚集体(ChloroStore)和质谱鉴定,本研究揭示了植物前体蛋白聚集体的主要组分,以及HSP100和HSP20分子伴侣在ChloroStore形成中和酵母/人类线粒体前体蛋白聚集体MitoStore形成中的保守功能,以及植物ChloroStore的特异性。本研究揭示了植物细胞应对cPOS的多层次响应全景图,为进一步研究提供了线索。
上海交通大学农业与生物学院博士后洪政辉为论文第一作者,武国章副教授为通讯作者。上海交通大学农业与生物学院硕士生朱丽宇、博士后高琳琳、博士生苏彤,云南大学生命科学学院朱喆、Leonard Krall、武旭娜研究员,德国马普分子植物生理研究所Ralph Bock院士也参与了本项工作。该研究获得国家自然科学基金、上海市现代种业协同创新中心项目、德国马普伙伴研究组项目、上海市“浦江人才”计划、上海市超级博士后、中国博士后面上项目等资助。
原文链接:
https://doi.org/10.1038/s41467-025-59043-3


.jpg)

.png)
.jpg)
.jpg)






 loading......
loading......