- 细胞发育与未来农业前沿论坛第四十六期成功举办 2025-04-14
- 北京师范大学任海云教授做客细胞发育与未来农业前沿论坛第二十七期 2023-11-24
- 德国马普植物生理所Reimo Zoschke博士做客细胞发育与未来农业前沿论坛第二十... 2023-11-23
- 清华大学刘玉乐教授做客细胞发育与未来农业前沿论坛第二十五期 2023-11-15
- 瑞士日内瓦大学教授Jean-David Rochaix做客植物细胞与发育前言论坛第二十三... 2023-09-24
- 中国科学院遗传与发育生物学研究高彩霞研究员做客植物细胞与发育前沿论坛第... 2023-09-04
- 韩国建国大学尹大珍(Dae-Jin Yun)教授做客细胞发育与未来农业前沿论坛第二... 2023-07-19
- 中国科学院遗传与发育生物学研究所谢旗研究员做客细胞发育与未来农业前沿论... 2023-06-06
- 奥地利科学技术研究院Daniel Zilberman教授做客细胞发育与未来农业前沿论坛... 2023-06-01
- 中国科学技术大学谭树堂教授做客细胞发育与未来农业前沿论坛第十七期 2023-05-28
- 山东农业大学卢从明教授做客细胞发育与未来农业前沿论坛第十六期 2023-05-22
- 荷兰拉德堡德大学须健教授做客细胞发育与未来农业前沿论坛第十五期 2023-05-18
- 中国科学院分子植物科学卓越创新中心刘宏涛研究员做客植物细胞与发育前沿论... 2023-04-04
- Nat Commun-方玉达/涂晓雨团队合作揭示组蛋白H2A通过cohesin靶向进行单泛素... 2023-03-06
- PNAS—薛红卫课题组与合作者揭示磷脂酸细胞器间转运进而调控叶绿体发育的机... 2023-02-02
-
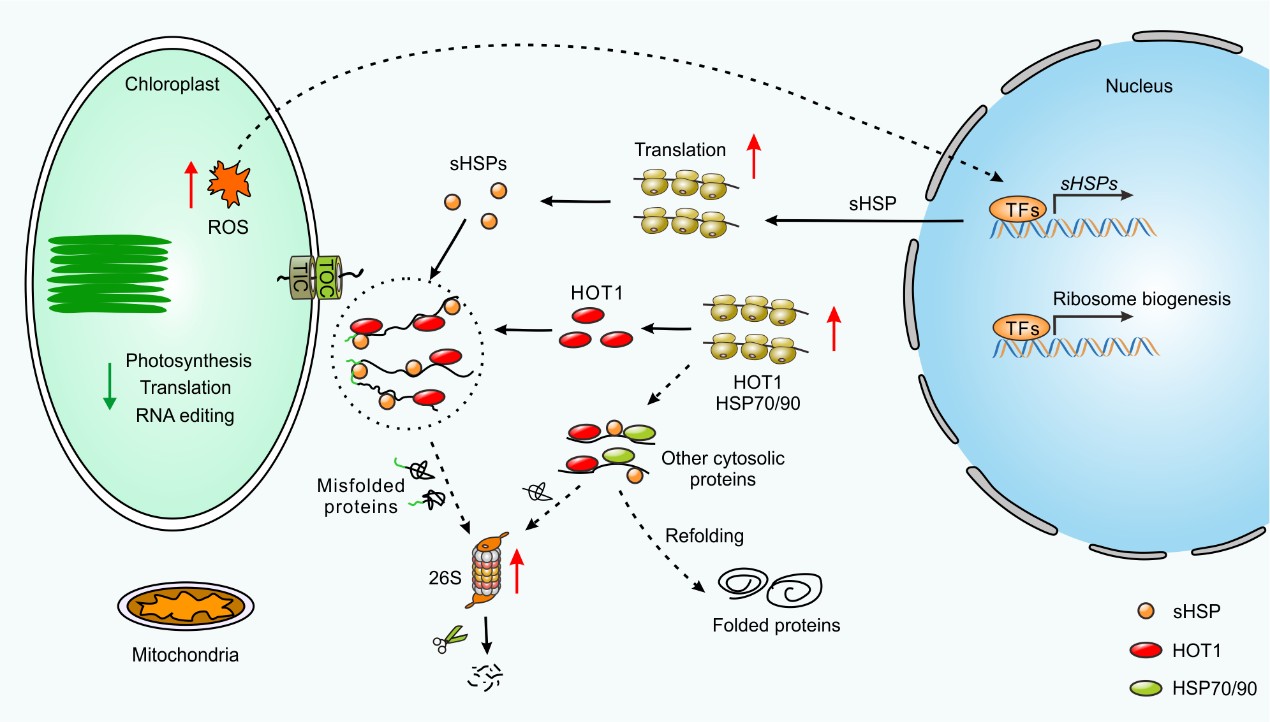
2025年4月22日,中心武国章课题组在国际权威综合性期刊Nature Communications上发表了题为“Chloroplast precursor protein preClpD overaccumulation triggers multilevel reprogramming of gene expression and a heat shock-like response”的研究论文,全面揭示了植物在多层次响应叶绿体前体蛋白积累的细胞学机制,证实蛋白翻译水平调控在激活分子伴侣蛋白(HSP)表达中的重要作用,发现叶绿体活性氧(cpROS)作为叶绿体逆向信号在转录水平激活小分子HSP的表达,证实细胞质分子伴侣ClpB1/HOT1在叶绿体前体蛋白过量积累时维持细胞蛋白稳态中的重要作用,为进一步理解叶绿体蛋白运输调控和逆境下蛋白稳态的维持机制提供了新线索。
俗话说:万物生长靠太阳,植物的叶绿体是接收太阳光能,进行光合作用碳固定的细胞器。作为半自主性细胞器,叶绿体基因组只保留了少量蛋白编码基因,叶绿体内95%以上的蛋白都是在细胞质核糖体上合成前体蛋白,前体蛋白在其N端的叶绿体信号肽引导下进入叶绿体,而后信号肽被剪切掉形成成熟形式的叶绿体蛋白。因此,叶绿体的正常发育和功能发挥均依赖于叶绿体的蛋白内运过程。在高光、高温等逆境条件下,叶绿体的蛋白内运效率下降,会造成叶绿体前体蛋白在细胞质中大量积累,导致细胞质蛋白稳态失衡和胁迫,影响植物生长和作物产量。然而,植物如何响应叶绿体前体蛋白过量积累胁迫(chloroplast precursor overaccumulation stress,cPOS)目前还大部分未知。

本研究通过诱导表达系统和组成型表达系统驱动细胞核编码的叶绿体蛋白ClpD的表达,成功构建了前体蛋白preClpD积累的转基因株系,获得了研究cPOS的良好植物材料。激光共聚焦显微镜观察发现前体蛋白preClpD主要围绕叶绿体外膜成点状聚集体分布,导致叶绿体超微结构受损,造成叶片黄化、光合能力下降、植物生长迟缓等表型。蛋白组学分析以及Western blot验证发现,前体蛋白积累会导致光合作用复合体含量降低,而细胞质核糖体亚基、翻译调控因子、26S蛋白酶体亚基和分子伴侣(HSP)等组分显著积累。Gene Ontology富集分析显示蛋白积累量上升的蛋白富集在“核糖体生物发生”和“蛋白翻译”等过程,多聚核糖体分析进一步证实蛋白翻译水平调控在植物响应前体蛋白过量积累中发挥重要作用。为了探究这些翻译水平调控的具体机制,本研究进行了转录组学和翻译组学联合分析,结合蛋白组学数据,揭示了植物细胞响应前体蛋白过量积累的多层次调控网络。结果显示,当cPOS发生时,叶绿体内的活性氧(cpROS)爆发作为逆向信号在转录水平激活小分子HSP的上调表达。然而,相较于转录水平调控,翻译水平调控在激活HSP表达中发挥更强的作用。为了探究这些HSP在cPOS响应过程中的作用,本研究对翻译水平上调最为显著的HSP100分子伴侣家族成员ClpB1/HOT1蛋白进行功能验证,证实了ClpB1/HOT1在cPOS发生时维持细胞蛋白稳态中的重要作用。
此外,通过分离前体蛋白聚集体(ChloroStore)和质谱鉴定,本研究揭示了植物前体蛋白聚集体的主要组分,以及HSP100和HSP20分子伴侣在ChloroStore形成中和酵母/人类线粒体前体蛋白聚集体MitoStore形成中的保守功能,以及植物ChloroStore的特异性。本研究揭示了植物细胞应对cPOS的多层次响应全景图,为进一步研究提供了线索。
上海交通大学农业与生物学院博士后洪政辉为论文第一作者,武国章副教授为通讯作者。上海交通大学农业与生物学院硕士生朱丽宇、博士后高琳琳、博士生苏彤,云南大学生命科学学院朱喆、Leonard Krall、武旭娜研究员,德国马普分子植物生理研究所Ralph Bock院士也参与了本项工作。该研究获得国家自然科学基金、上海市现代种业协同创新中心项目、德国马普伙伴研究组项目、上海市“浦江人才”计划、上海市超级博士后、中国博士后面上项目等资助。
原文链接:
https://doi.org/10.1038/s41467-025-59043-3
-
4月5日,Molecular Horticulture在线发表了上海交通大学农业与生物学院方玉达课题组有关DNA甲基化调控植物基因组加倍过程中转录稳态的研究论文,题为Regulation of transcriptional homeostasis by DNA methylation upon genome duplication in pak choi。该研究发现在同源四倍体不结球白菜中,非差异表达基因两侧的转座元件的DNA甲基化水平升高。相反,与差异甲基化区域相关的基因重叠的差异表达基因的转录水平与这些差异表达基因的DNA甲基化水平呈负相关。这些结果阐明了多倍体植物中 DNA 甲基化在基因转录稳态调控中的作用,以及十字花科植物应对基因组加倍所引发的“基因组冲击”的机制。

背景介绍
多倍化是植物进化和作物育种的重要力量。70%的被子植物经历过一次或多次基因组加倍事件。多倍体园艺植物的品种繁多,因其具有较强的抗病性和优良的农艺性状而被广泛利用。不结球白菜(俗称小白菜)作为十字花科(Cruciferae)芸苔属(Brassica)中重要的蔬菜作物之一,深受中国消费者喜爱。国内外育种学家们长期致力于杂交选育新品种,使得不结球白菜遗传资源丰富多样。另外,通过基因组倍性改变的倍性育种是小白菜遗传改良的重要内容。与其二倍体相比,同源四倍体不结球白菜通常表现出晚花、叶片变厚的表型,收获时的品质和产量更好。
与异源四倍体相比,同源四倍体的遗传背景不受杂交的影响,更适合揭示多倍体物种中基因表达的调控机制。由于基因组加倍过程中不涉及 DNA 序列的改变,其基因表达的改变通常与表观遗传密切相关。深入研究植物多倍化过程中 基因表达调控的表观遗传机制对多倍体育种的理论支撑至关重要。
研究结果
本研究中,作者首先发现不结球白菜基因组加倍后差异表达基因占全部基因的比例较低(5.45 %),而非差异表达基因占全部基因的绝大多数,达94.55 %。 差异表达基因在RNA 聚合酶通路中富集最为显著(Fig. 1)。

Fig. 1 Bc2X和Bc4X之间的差异表达基因的表征
基因组加倍后,差异甲基化区域分别包含了12,857 个 差 异 高 甲 基 化 基 因 和 8,451 个差异低甲基化基因。差异甲基化基因与差异表达基因在一定范围内显著重叠,其中,差异低甲基化与差异上调基因显著交集;差异高甲基化在基因体的 1 kb 两侧区域与差异下调基因显著富集;差异低甲基化在基因体区域与下调差异表达基因显著交集。此外,差异DNA 甲基化水平与差异表达基因的表达水平呈负相关(Fig. 2)。

Fig. 2 Bc2X和 Bc4X的差异甲基化基因的功能预测及其与差异表达基因的富集
在二倍体(Bc2X)和四倍体(Bc4X)小白菜中,有转座元件插入的基因总体转录水平显著低于没有转座元件插入的基因,无论转座元件插入基因体还是其 1 kb 两侧区域。在基因组加倍后,差异表达基因相关的转座元件甲基化没有显著变化,无论转座元件是在基因体内还是在 1 kb 两侧区域,而非差异表达基因两侧转座元件的甲基化水平显著增加(Fig. 3),这些结果揭示了 DNA 甲基化在同源四倍体植物的基因转录调控中的作用。在基因组加倍过程中,大部分基因的转录维持不变,有助于多倍体细胞稳态的维持,这个过程受到这些基因两侧转座元件DNA甲基化升高的调控。

Fig. 3 非差异表达基因与相邻转座元件的甲基化变化的关系
上海交通大学农业与生物学院马敏博士和博士生王远达为论文共同第一作者,方玉达教授为论文通讯作者。上海交通大学孙镇菲副研究员、研究生赵冉泽、李晓璇和李虹桦、上海农科院朱红芳研究员和杨学东副研究员以及南京农业大学张昌伟副教授参与了本研究。本研究得到了上海市农业研究系统和国家自然科学基金的资助。
论文链接:https://molhort.biomedcentral.com/articles/10.1186/s43897-025-00145-3
-
近日,中心张欢课题组在Plant Biotechnology Journal 杂志上在线发表了题为“Sunlight-sensitive carbon dots for plant immunity priming and pathogen defence”的研究论文。该研究工作设计合成了一种光敏性可降解的碳点 (Carbon Dots, CDs),该CDs在增强植物抗病性的同时不会影响植物的产量,还可充当广谱的抗真菌剂。

极端天气与病原菌威胁全球粮食安全,传统防治手段因抗药性及污染受限。碳点(CDs)作为低成本、可降解的零维碳基材料,兼具光敏特性与高生物相容性,能增强植物光合作用、抗逆性及免疫应答。本研究通过水热法开发光敏CDs,发现其浓度依赖性双模功能:低浓度激活植物免疫基因,高浓度光催化直接杀菌。该策略突破传统纳米材料环境累积风险,为开发智能绿色农药提供新思路。
主要研究结果如下:
1. CDs的合成和理化性质表征
作者使用邻苯二胺和胱氨酸通过一步水热反应制备了2-5 nm的正电性CDs。傅里叶变换红外光谱和紫外可见吸收(UV-vis)光谱表明CDs富含N-H C-C、C=O/C=N、C=C和CO-NH等富电子官能团。在365 nm波长的光照下,CDs 的UV-vis光谱在~452 nm处出现了新的吸收峰,且随着光照时间的延长,该吸收峰的强度逐渐增强,同时位于228 nm 处的C=C的吸收峰逐渐减弱(图1f)。电子自旋共振波谱(图1g)证明该CDs在太阳光照下(氙模拟太阳光全光谱)可同时产生1O2、O2˙−和 ˙OH三种ROS(图1g)。CDs表面的富电子基团和共轭结构赋予CDs光生ROS的性质,同时,CDs产生的ROS能氧化自身含氮和含硫基团,导致新的吸收峰的出现。此外,当CDs暴露于户外90 d后,其FTIR和UV-vis特征峰逐渐变弱甚至消失,表明了CDs的可降解性和环境兼容性。

图1, CDs合成和表征。
2. CDs激活植物的免疫反应
基于ROS的双重生物学功能以及CDs可在太阳光照下产生ROS的特性,作者推测可以利用CDs产生的ROS来触发植物自身的防御反应。作者首先使用CDs喷施处理(浓度为240 mg/L)烟草和番茄植株的叶片,并在处理后4~8 h内观察到了ROS的爆发。另外,CDs处理还增强了植物抗氧化酶活性,表明CDs处理扰乱了植物自身的氧化还原稳态。使用灰葡萄孢菌侵染CDs预处理的番茄和烟草植株发现,CDs预处理可以显著降低烟草(33%)和番茄(12%)灰霉病的发病率。同时,使用辣椒疫霉孢子侵染CDs预处理的番茄叶片后,发病率降低了31%。ROS信号被认为是介导PTI和ETI下游免疫反应的重要次级信使,作者猜测CDs在原位产生的ROS通过损害植物表皮蜡质层和细胞壁,触发植物内部的系列免疫响应,如ROS爆发和抗氧化酶活性变化等。
 图 2, CDs诱导ROS爆发,增强烟草和番茄植株对灰霉病的抗性。
图 2, CDs诱导ROS爆发,增强烟草和番茄植株对灰霉病的抗性。为探究CDs诱导植物防御反应的机制,作者使用240 mg/L的CDs喷施处理了番茄叶片,并对处理后12 h和24 h的叶片进行了转录组分析。GO富集结果表明,CDs处理组的DEGs显著富集在细胞内源性刺激以及氧化还原等途径,表明CDs处理作为外部刺激激活了植物的抗氧化防御反应。对DEGs 进行KEGG富集分析后发现,处理12 h后的DEGs主要富集含硫氨基酸代谢,类黄酮、甾醇和谷胱甘肽等抗氧化相关物质的生物合成以及植物激素信号转导等通路。处理24 h 后的DEGs显著富集在光合作用天线蛋白、植物激素信号、MAPK信号级联,类固醇、苯丙氨酸、苯丙烷和蜡质等的生物合成过程。钙离子内流、ROS爆发、MAPK级联和防御激素响应等被认为是植物防御反应的第一道防线,这些信号可以介导下游,包括细胞壁增强、抗毒素生物合成等反应。而角质、蜡质和木质素是植物的主要屏障,可以保护植物细胞壁免受病原菌的水解,增强植物的抗病性。作者注意到在苯丙烷生物合成途径中,多个参与木质素合成的关键酶基因被显著调节。研究表明,POD在ROS的参与下介导木质素的生物合成。因此,综合CDs处理之后叶片中ROS的爆发和氧化还原稳态的变化等的结果,作者猜测本研究中POD和SOD活性提高以及ROS的生成可能与植物细胞壁增强有关。综上,作者认为CDs在叶片表面原位产生的ROS造成了植物叶片表面蜡质、细胞壁等的氧化损伤,破坏了细胞壁的完整性,从而诱导了包括木质素、角质和蜡质的合成、ROS爆发以及抗毒素的合成等系列免疫响应,增强了植物的抗病性。
鉴于持续ROS会导致氧化损伤毒性,影响植物生长和发育,作者进一步评估了CDs处理对植物光合作用和产量的影响。结果表明,CDs处理(即使高浓度处理)不会影响植物的正常生长和产量。
 图 3, CDs处理对番茄叶片转录水平的影响。
图 3, CDs处理对番茄叶片转录水平的影响。3. 光敏性CDs的广谱抗真菌活性
作者还研究了CDs在持续阳光照射(氙灯模拟,9.4×10⁴ lux)下的抗真菌能力,探索CDs在田间病原微生物防治中的效果。结果表明,不同浓度CDs处理对B. cinerea菌丝生长的影响程度不同, 480 mg/L浓度CDs 处理下, 可以造成疫霉(P. capsici)、核盘菌(S. sclerotiorum)和灰葡萄孢菌(B. cinerea)的菌丝生长均被显著抑制,抑制率分别为66.5%,88.3%和100%,单独的光照处理和黑暗+CDs处理对菌丝生长没有影响,表明CDs具有独特的光诱导抗菌活性。作者还利用透射电镜和扫描电镜研究了CDs处理对灰葡萄孢菌菌丝和孢子形貌结构的影响,发现CDs处理后菌丝和孢子细胞壁结构严重破损,而对照组菌丝和孢子的结构完整,表面光滑。结合CDs处理对菌丝和孢子转录水平的影响,作者认为CDs在连续光照下产生的ROS不仅造成了病原菌细胞壁细胞膜等结构的损伤,还造成了细胞核内核酸的氧化损伤,最终导致孢子和菌丝的失活,降低了其侵染活力及传染能力。

图 4,CDs的抑菌活性。
结论
在这项研究中,作者开发了能够产生ROS、对太阳光敏感、可降解的CDs。该CDs可以作为植物免疫引发剂的同时还可作为广谱的抗真菌剂。在自然生长条件下,低浓度(240 mg/L)CDs产生适量的ROS,诱导细胞壁损伤介导的系列免疫反应,如ROS爆发、MAPK级联、植保素和木质素的积累,增强植物抗病性。持续光照下,高浓度(≥480 mg/L)CDs原位产生ROS可以造成疫霉(P. capsici)、核盘菌(S. sclerotiorum)和灰葡萄孢菌(B. cinerea)的结构损伤,使病原菌菌丝和孢子失活,可以预防植物疾病的发生和传播。CDs的免疫刺激和杀菌的双重功能为可持续植物保护提供了创新策略。此外,CD的可降解性和低毒性使其有望成为化学杀虫剂和杀菌剂的独特和安全的替代品。
上海交通大学农业与生物学院博士后寇尔丰博士为论文第一作者,张欢副教授(https://www.agri.sjtu.edu.cn/Data/View/6442)为该研究工作的通讯作者。感谢加州大学伯克利分校Markita Landry教授对该工作提供的宝贵意见。该研究工作得到了国家自然科学基金、博士后面上项目、国家资助博士后人员计划、上海市浦江人才计划等项目的资助。
上海交通大学张欢课题组因科研工作需要,现招聘2-3名博士后,研究方向包括但不限于:植物高效靶向递送体系构建、基因编辑在植物中的应用、RNA农药开发、植物成像等纳米技术与植物学交叉研究。有意者请发送个人简历至zhang_huan@sjtu.edu.cn。
论文链接:https://onlinelibrary.wiley.com/doi/10.1111/pbi.70050
-
近日,中心包岩课题组联合美国密歇根州立大学Dean DellaPenna教授团队,在The Plant Cell 杂志发表了题为“A family of α/β hydrolases removes phytol from chlorophyll metabolites for tocopherol biosynthesis in Arabidopsis”的研究论文,揭示了一类α/β水解酶协同调控拟南芥生育酚代谢稳态的分子机制。

生育酚(tocopherol)又称为维生素E(Vitamin E),是光合生物体产生的一类脂溶性抗氧化物,对人类健康,对维持种子寿命和提高植物对高温、高光强等非生物胁迫的应对能力起到重要调节作用。近三十多年的研究表明,叶绿素水解产生的植醇基团(phytol)是贡献于生育酚合成的最重要来源,但是参与该代谢途径的相关水解酶尚未被详细解析,是领域内亟待解决的一个重要科学问题。

图1. 叶绿素与生育酚代谢调控关系途径总览。
α/β水解酶是植物中最大也是最重要的一类水解酶,在模式植物拟南芥中就有超过600个成员,参与了包括各种化合物代谢如激素合成等多个途径。高度的基因冗余性和底物特异性阻碍了对其分子机制和生理生化功能的解析。结合进化生物学、遗传学、分子与细胞生物学及相关生理生化等手段,课题组成功锁定了两个新的α/β水解酶并命名为CLD2和CLD3,发现其与PPH、CLD1和VTE7一起通过水解叶绿素及其中间代谢物,并控制这些基因在不同组织和不同环境条件下的差异化表达,协同调控了叶绿体中生育酚的代谢稳态。该发现拓展并加深了我们对以叶绿素为代谢前体的生育酚合成途径的理解,是课题组围绕“细胞器稳态与植物环境可塑性”研究中取得的阶段性成果,对全面揭示叶绿素的完整代谢途径及生育酚等合成过程起到了重要推动作用,为改善农作物营养价值和提高植物环境适应能力提供了重要理论支撑。

图2. vte7 cld123pph 五突变体中叶绿素与生育酚含量的遗传关系分析。
上海交通大学农业与生物学院为该论文第一署名单位;学院植科系长聘教轨副教授包岩为该论文第一作者兼通讯作者;美国科学院院士、密歇根州立大学荣休教授Dean DellaPenna为该论文共同通讯作者;2022级博士研究生牛越参与了该项研究工作。本项目得到了上海市现代种业协同创新中心、上海市科委和农委等项目的资助。


.jpg)

.png)
.jpg)
.jpg)






 loading......
loading......